Los átomos de carbono pueden formar enlaces covalentes con otros elementos: como con el oxigeno, nitrógeno flúor, cloro, bromo, yodo, azufre y fósforo.
Un GRUPO FUNCIONAL de una molécula orgánica es un átomo o grupo de átomos que siempre reaccionan de una forma determinada.
Pueden ser átomos, grupos de átomos o arreglos en los átomos, así, los dobles y triples enlaces también se consideran GRUPOS FUNCIONALES.
TIPO DE COMPUESTO
|
FORMULA GENERAL
|
GRUPO FUNCIONAL
|
Alcohol
|
R-OH
|
HIDROXILO
|
Amina
|
R-NH2
|
AMINO
|
Aldehído
|
R-CHO
|
CARBONILO
|
Cetona
|
R-CO-R
|
CARBONILO
|
Ácido Carboxílico
|
-COOH-
|
CARBOXILO
|
Éster
|
-COO-
|
ÉSTER
|
Amida
|
-CONH-
|
AMIDA
|
Éter
|
R-O-R
|
ÉTER
|
 >ALCOHOLES.
>ALCOHOLES.
Resultan de sustituir uno o varios hidrógenos de los hidrocarburos no aromáticos por el grupo funcional HIDROXILO y representa mediante R-OH.
Los alcoholes mas simples se nombran cambiando la ultima letra del alcano correspondiente por el sufijo "OL", de este modo, el alcohol de un átomo de carbono se llama metanol o alcohol metílico y el segundo etanol o alcohol etílico Se toma como cadena principal la mas larga que contenga el grupo hidroxilo y se le numera otorgándole el localizador mas bajo.Son compuestos covalentes polares, atraen a las moléculas del agua; los alcoholes de bajo peso molecular son solubles en agua.
-Acidez y basicidad de los alcoholes
Los alcoholes son ácidos, el hidrógeno del grupo -OH tiene un pKa de 16.
-Propiedades físicas
Los puntos de fusión y ebullición son elevados debido a la formación de puentes de hidrógeno.
-Síntesis de alcoholes
Se obtienen mediante sustitución nucleófila y por reducción de aldehídos y cetonas. El ataque de reactivos organometálicos a electrófilos -carbonilos, epoxidos, esteres- es un método importante en la síntesis de alcoholes.
-Obtención de haloalcanos a partir de alcoholes
Los alcoholes se transforman en haloalcanos por reacción con PBr3. El mecanismo es del tipo SN2 y requiere alcoholes primarios o secundarios.
-Oxidación de alcoholes
El trióxido de cromo oxida alcoholes primarios a ácidos carboxílicos y alcoholes secundarios a cetonas. También se pueden emplear otros oxidantes como el permanganato de potasio o el dicromato de potasio.
>ALDEHÍDOS (Doble enlace entre carbono y oxígeno -CO-
GRUPO CARBONILO)
 Contiene el grupo carbonilo en un extremo de la cadena y responden a la fórmula R-CHO. En este caso el grupo carbonilo esta unido a un átomo de hidrógeno y un radical. Se nombran sustituyendo la terminación -ano por -al. Esta formado por un oxigeno que se enlaza con un carbono mediante enlaces covalentes.Son muy reactivos. Son aldehídos el metanal o formaldehído HCHO, y el etanal o acetaldehído CH3-CHO.
Contiene el grupo carbonilo en un extremo de la cadena y responden a la fórmula R-CHO. En este caso el grupo carbonilo esta unido a un átomo de hidrógeno y un radical. Se nombran sustituyendo la terminación -ano por -al. Esta formado por un oxigeno que se enlaza con un carbono mediante enlaces covalentes.Son muy reactivos. Son aldehídos el metanal o formaldehído HCHO, y el etanal o acetaldehído CH3-CHO.
Propiedades Físicas:
Los de pocos carbonos tienen olores característicos. El metanal produce lagrimeo y es gaseoso. Hasta el de 12 carbonos son líquidos y los demás sólidos.
Los puntos de ebullición son menores que los alcoholes respectivos de igual cantidad de carbonos.
Todos son de menor densidad que el agua. Los más chicos presentan cierta solubilidad en agua, pero va disminuyendo a medida que aumenta la cantidad de carbonos.
Propiedades Químicas:
Los aldehídos tienen buena reactividad. Presentan reacciones de adición, sustitución y condensación.
-ADICCIÓN DE HIDRÓGENO
-ADICCIÓN DE OXIGENO
-Reducción del Nitrato de plata (AgNO3) amoniacal ( Reactivo de Tollens).
La plata en medio amoniacal es reducida por el aldehído. Esto se verifica por la aparición de un precipitado de plata llamado espejo de plata en el fondo del tubo d ensayo.
-REDUCCIÓN DEL LICOR DE FEHILING
-SUSTITUCIÓN DE ALOGENOS.
Los aldehídos reaccionan con el cloro dando cloruros de ácidos por sustitución del hidrógeno del grupo carbonilo.
-ALDOLIZACIÓN
Se da cuando dos moléculas de aldehído se unen bajo ciertas condiciones como la presencia de hidróxidos o carbonatos alcalinos.
Al unirse se forma una molécula que tiene una función alcohol y otra función aldehído en la misma molécula.
>CETONAS
Poseen el grupo carbonilo unido a otros 2 átomos de carbono de una cadena y responden a la fórmula
R-CO-R´.
Se nombran sustituyendo la terminación -ano por -ona.
La cetona mas típica es la propanona o acetona de formula CH3-CO-CH3.

Propiedades físicas
Las primeras diez son líquidas y a partir del carbono 11 son sólidas. Son solubles en éter, alcohol y cloroformo; la acetona es soluble en agua en cualquier proporción pero las siguientes son menos solubles. Las primeras tienen olor agradable que a medida que aumenta el número de átomos de carbono se vuelve desagradable. Las superiores son inodoras. Todas las cetonas alifáticas son menos densas que el agua.
La acetona es muy buen disolvente de esmaltes, yodo y aceites.
Propiedades químicas
Al hallarse el grupo carbonilo en un carbono secundario son menos reactivas que los aldehídos. Solo pueden ser oxidadas por oxidantes fuertes como el permanganato de potasio dando como productos dos ácidos con menor número de átomos de carbono. Por reducción dan alcoholes secundarios.
No reaccionan con el reactivo de Tollens para dar el espejo de plata como los aldehídos, lo que se utiliza para diferenciarlos. Tampoco reaccionan con los reactivos de Fehling y Schiff.
Obtención:
El método más utilizado es la oxidación de alcoholes secundarios.
>ÁCIDOS CARBOXÍLICOS (Unión -en el mismo átomo de carbono- del grupo carbonilo -C=O- y el grupo hidroxilo
-OH.
GRUPO CARBOXILO)

El grupo carboxilo tiene un marcado carácter ácido, por lo que, cuando se une a un radical, forman los ácidos carboxílicos. Estos compuestos orgánicos se forman cuando el hidrógeno de un grupo aldehido es remplazado por un grupo -OH.
Se nombran cambiando la terminación -ano por -ico.
Se toma como cadena principal la más larga que contenga al grupo carboxilico y se numera empezando por dicho grupo.

-Propiedades: presentan punto de ebullición y fusión elevadas, debido a los puentes de hidrógeno, las moléculas se unen de dos en dos formando DÍMEROS. También presentan olores desagradables.
-Son ácidos, pero también pueden comportarse como base si se protona sobre el grupo carbonilo. Tienen 2 enlaces carbono-oxigeno. Los mas pequeños (4 carbonos) son solubles en agua. Puros o en disolución acuosa se encuentran formando dímeros unidos mediante puentes de hidrógeno. Forman sales metálicas al combinarse con metales.
-Obtención. Se obtienen por Oxidación de alcoholes primarios o aldehidos, Oxidación de grupos alquilo (cadenas laterales primarias
y secundarias) en anillos aromáticos (posiciones bencílicas); estabilidad
del anillo aromático, oxidación de alquenos, hidrólisis de nitrilos (cianuros) en medio ácido o básico.
>ÉSTERES

Son sales de los ácidos carboxílicos que resultan de la combinación de un ácido carboxílico con un alcohol. Los ésteres proceden de condensar ácidos con alcoholes y se nombran como sales del ácido del que provienen. La nomenclatura IUPAC cambia la terminación -oico del ácido por -oato, terminando con el nombre del grupo alquilo unido al oxígeno.
-Propiedades: Tiene aromas fuertes. Los de bajo peso molar son líquidos de olor agradable, similar al de la esencia de las frutas que los contienen. Los ésteres de ácidos superiores son sólidos cristalinos, inodoros. solubles en solventes orgánicos e insolubles en agua. Su densidad es menor que la del agua S.on volátiles.
-Obtención.
Hidrólisis ácida:
Por calentamiento con agua se descompone en el alcohol y el ácido de los que proviene.
éster + agua ------------- ácido + alcohol
Con un exceso de agua la reacción es total. Es un proceso inverso a la esterificación.
CH3.CO.O.CH3 + H2O ------------ CH3.CO.OH + H.CH2.OH
Hidrólisis alcalina - Saponificación
En presencia de un hidróxido y con exceso de agua y calor, se produce una reacción que da como productos el alcohol y la sal del ácido del que proviene. Esta sal es el jabón lo que da el nombre a la reacción.
éster + hidróxido -------------- sal de ácido + alcohol.
.png) >ÉTER
>ÉTER
Son los compuestos formados por 2 radicales unidos entre sí mediante un átomo de oxígeno, por lo que su grupo funcional es: R-O-R (ÉTER).
Los radicales que se unen al oxigeno pueden ser iguales o diferentes. La nomenclatura consiste en nombrar las cadenas carbonadas por orden alfabético y terminar el nombre con la palabra éter (dimetiléter).
-Propiedades: Son compuestos de gran estabilidad, muy usados como disolventes inertes por su baja reactividad.
Sus puntos de ebullición son menores que los alcoholes que lo formaron pero son similares a los alcanos de pesos moleculares semejantes. A diferencia de los alcoholes no establecen uniones puente de hidrógeno y esto hace que sus puntos de ebullición sean significativamente menores.
Son algo solubles en agua. Son incoloros y al igual que los ésteres tienen olores agradables. El más pequeño es gaseoso, los siguientes líquidos y los más pesados sólidos.
Propiedades Químicas:
No tienen hidrógenos activos como en los casos de los alcoholes o ácidos. Por este motivo son inertes ante metales como el sodio o potasio o litio. Necesitan del calor para descomponerse y ahí si poder reaccionar con algunos metales.
-Obtención: se obtiene por reacción de halocanos primarios y alcóxidos, llamada síntesis de Williamson. También se puede obtener mediante reacción SN1 entre alcoholes y haloalcanos secundarios o terciarios. Un tercer método consiste en la condensación de alcoholes en un medio ácido.
>AMINA (compuesto con Nitrógeno)
 Son compuestos orgánicos (-NH2) que, junto a las AMIDAS, tiene nitrógeno. Se pueden considerar como derivados del amoniaco NH3 en donde se sustituye uno, dos o tres átomos de hidrógeno por una cadena de hidrocarburo.
Son compuestos orgánicos (-NH2) que, junto a las AMIDAS, tiene nitrógeno. Se pueden considerar como derivados del amoniaco NH3 en donde se sustituye uno, dos o tres átomos de hidrógeno por una cadena de hidrocarburo.
Su grupo funcional corresponde al amino.
La metilamina CH3-NH2 o el etilmetilamina CH3-CH2-NH-CH3, son ejemplos de este tipo de compuesto.
Contienen los elementos C, H y N y se derivan del amoniaco por sustitución de uno, dos o tres átomos de hidrógeno para formar aminas primarias, secundarias y terciarias. Se nombran añadiendo al nombre del radical hidrocarbonado el sufijo "-amina". En las aminas secundarias y terciarias, si un radical se repite se utilizan los prefijos "di-" o "tri-", aunque, frecuentemente, y para evitar confusiones, se escoge el radical mayor y los demás se nombran anteponiendo una N para indicar que están unidos al átomo de nitrógeno.
-Propiedades: Las aminas presentan puntos de fusión y ebullición más bajos que los alcoholes. Así, la etilamina hierve a 17ºC, mientras que el punto de ebullición del etanol es de 78ºC. La menor electronegatividad del nitrógeno, comparada con la del oxígeno, hace que los puentes de hidrógeno que forman las aminas sean más débiles que los formados por los alcoholes.
También se observa que las aminas primarias tienen mayores puntos de ebullición que las secundarias y estas a su vez mayores que las terciarias. La amina terciaria no puede formar puentes de hidrógeno (carece de hidrógeno sobre el nitrógeno), lo que explica su bajo punto de ebullición.
Las aminas con menos de siete carbonos son solubles en agua.
-Obtención.Las aminas se pueden obtener mediante la síntesis de estas por la alquolación directa, la reducción de nitrilos, reducción de azidas, reducción de aminas, etc.
 >AMIDA
>AMIDA
Se considera que derivan de la sustitución de un grupo hidroxilo (-OH) de un ácido carboxílico por el grupo (-NH2), (por tanto responde a la formula R-CO-NH2.), en los que se ha sustituido el grupo —OH por el grupo —NH2, —NHR o —NRR', con lo que resultan, respectivamente, las llamadas amidas primarias,secundarias o terciarias, que también se llaman amidas sencillas, N-sustituidas o N-disustituidas. Su grupo funcional es el amida.
Un amida muy importante es la diamida ( 2 grupos de -NH2) del ácido carbónico (H2CO3) -Urea-.
-Propiedades: El grupo funcional amida es bastante polar, lo que explica que las amidas primarias, excepto la formamida (p.f.=2,5 ºC), sean todas sólidas y solubles en agua. Sus puntos de ebullición son bastante más altos que los de los ácidos correspondientes, debido a una gran asociación intermolecular a través de enlaces de hidrógeno, entre el oxígeno negativo y los enlaces N—H, mucho más polarizados que en las aminas. Los puntos de fusión y de ebullición de las amidas secundarias son bastante menores, debido principalmente al impedimento estérico del radical unido al nitrógeno para la asociación. Como es natural, las amidas terciarias (sin enlaces N—H) no pueden asociarse, por lo que son líquidos normales, con puntos de fusión y de ebullición de acuerdo con su peso molecular.
-Obtención: se obtiene al hacer reaccionar un ácido carboxílico con amoniaco o con una amina.
REFERENCIAS BIBLIOGRÁFICAS.
> RICO, Galicia Antonio; PEREZ, Orta Rosa Elba.
"Quimica. Segundo Curso para estudiantes del bachillerato del CCH"
Colegio de Ciencias Humanidades.
Ciudad Unievrsitaria, México DF .
pp. 160-168.


 5.- En la superficie del queso formado coloca una cuchara pequeña de madera y si no se hunde indica que ya está listo.
5.- En la superficie del queso formado coloca una cuchara pequeña de madera y si no se hunde indica que ya está listo.


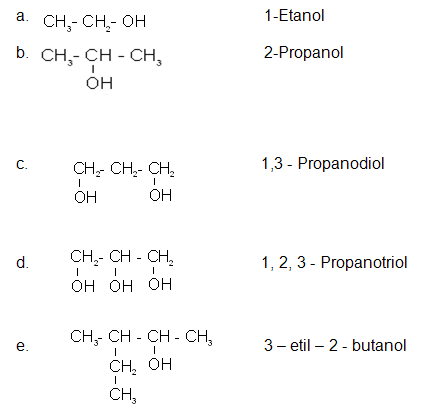














.png)





